【お願い】
「こころみ医学の内容」や「病状のご相談」等に関しましては、クリニックへのお電話によるお問合せは承っておりません。
診察をご希望の方は、内科外来の特徴と流れ をお読みください。
慢性骨髄性白血病の症状・診断・治療
慢性骨髄性白血病(CML)

慢性骨髄性白血病(CML:Chronic Myelogenous Leukemia)は、造血幹細胞に異常が起こり、腫瘍化した血液細胞が無制限に増殖する病気です。
検査値の異常として最も目立つのは白血球増加ですが、同時に血小板数の増加や赤血球の増加を認めることもあります。
慢性骨髄性白血病では、造血幹細胞にはある程度の成熟機能があります。
白血球が腫瘍化して白血病細胞となっても、初期には正常の白血球とほぼ同じ働きをします。
進行は通常ゆっくりなので初期の段階では症状があまり目立ちません。
健康診断などで白血球数の増加を指摘され、それがきっかけに白血病とわかるケースが半数以上を占めます。
一方、病気が進行すると、次第に白血球数の増加による全身の倦怠感、寝汗、食欲低下や体重減少、脾臓(ひぞう)の腫大による腹部の張りなどの症状があらわれます。
発症から3~5年は症状がおだやかな慢性期が続きますが、じきに急性骨髄性白血病と同じような病態になります。
正常な赤血球、白血球、血小板が減少して貧血、感染症、出血などの症状が急に出現する『急性転化』という現象をおこすため、注意が必要です。
この白血病は『フィラデルフィア染色体』という正常な人には無い染色体異常がみられるのが特徴で、治療はそこから発生する異常なたんぱく質を抑える分子標的薬の有効性が認められています。
若い人にも発症しますが、40歳代後半から50歳代をピークに中高年層で多く発症します。
慢性骨髄性白血病(CML)の症状

慢性骨髄性白血病(CML)は急性骨髄性白血病(AML)に比べ、発症から3~5年はあまり症状が目立ちません。
慢性期・移行期・急性期と3つの病期をたどるのが特徴で、それぞれ症状の現れ方が異なります。
慢性期の症状
発症から3~5年は、慢性期と呼ばれる比較的おだやかな時期が続きます。
自覚症状としては、白血球数の増加により、
- 脾臓の腫れ(お腹の腫れ)
- 肝腫大(お腹の腫れ)
- 体重減少、食欲低下
- 全身倦怠感
- 微熱
このような症状が認められます。
自覚症状がないまま白血球の異常な増加を指摘され、そこから精査して診断を受ける患者さんがほとんどです。
病気が進行すると、次第に白血球数や血小板数の増加による症状や、正常血球減少による症状が目立ち始めます。
移行期・急性期の症状
3~5年の慢性期の後、急性骨髄性白血病とよく似た病態をみせるようになります。
この時期になると、急性白血病と同じように未熟な状態の白血病細胞が増殖するようになり、成熟した血球が減少するため様々な症状をおこすようになります。
また、増加した白血病細胞が全身へ広がり、他の組織に症状がみられることもあります。
具体的には、
- 脾臓の腫れが増悪する
- 感染症(白血球の減少で免疫力が低下する)
- 貧血症状(赤血球の減少)
- 鼻や歯肉から簡単に出血したり、アザができやすくなったりする(血小板の減少)
- 骨痛(白血病細胞が骨の中で増殖するため)
- 頭痛や吐き気(中枢神経への影響)
などがあります。
慢性骨髄性白血病の進行(病期)
慢性骨髄性白血病は、状態によって慢性期、移行期、急性転化期(急性期・芽球期)の3つの病期に分けられます。
慢性期
白血球数と血小板数は増加しているものの、自覚症状を伴わないことが少なくありません。
患者さんが病気に気づくのは、他の目的で血液検査を行い、白血球数などの異常を指摘されて精査を受けた結果ということが多いです。約85%の人がこの時期に診断を受けています。
慢性期は3~5年で、この時期に適切な治療を行わなかった場合や、治療を行っても効果が得にくかった場合には、移行期を経て急性転化期へと進行します。
移行期や急性転化期に入ると治療が難しくなってくるため、慢性期を維持することが治療の目的となります。
慢性期においては、骨髄内と血液中の芽球(白血病細胞)の割合は10%未満です。
移行期
慢性期の治療が不十分で3~5年経過すると、病的な白血病細胞の分化能(成熟する能力)が失われ、骨髄や血液中に急性白血病でみられる『芽球』という未熟なままの細胞が増加します。
同時に白血病細胞の増殖能力が高まり、骨髄内で芽球の割合が増え、成熟した血球細胞が減少してしまいます。
その結果、治療による白血球数のコントロールは困難になり、脾臓の腫れが進行したり、正常な血球不足により貧血、出血傾向、発熱などの症状が現れることもあります。
移行期は個人差があり、移行期がほとんどないまま急性転化期に突入する患者さんもいます。
移行期においては、骨髄内や末梢血中の芽球の割合は10%以上20%未満です。
急性転化期
元はある程度の分化能を持っていた白血病細胞の分化能がほぼ失われ、急性骨髄性白血病と同じように、細胞が非常に未熟なままの状態(芽球)で無限の増殖を始めます。
急性期とも呼ばれ、骨髄や血液中では芽球の割合が増加し、成熟した血球細胞が急速に減少していきます。
そのため、赤血球減少による貧血症状、白血球減少による感染症、血小板減少による出血症状などが急に目立つようになります。
また、白血病細胞が骨や皮膚やリンパ節に腫瘤を形成したり、脳や脊髄などの中枢神経に白血病細胞が広がり、激しい頭痛や吐き気を認めることもあります。
この時期になると慢性期と同じような治療では効果がなく、強い抗がん剤を使った治療を行います。
治癒を目指すためには造血幹細胞移植を行い、全身状態や年齢などによって慎重な検討が必要です。
急性転化期においては、骨髄内や末梢血中の芽球の割合は20%以上になります。
慢性骨髄性白血病(CML) の診断基準
慢性骨髄性白血病(CML)の診断では、以下の点を重視して診断します。
- フィラデルフィア染色体が確認される
- 白血球が1万/μL以上に増加している
- 白血球の中でもとくに好塩基球が増加している
- 末梢血に通常では認められない各分化段階の未熟な骨髄球系細胞(骨髄芽球から後骨髄球まで)が出現している
慢性骨髄性白血病(CML)は、白血球の増加を特徴とします。
半数以上の患者さんで白血球数10万/μL以上(基準値の10倍以上)になります。
白血球の中でも、正常なら数の少ない好塩基球が増加していると、慢性骨髄性白血病(CML)の疑いが高くなります。
それ以外は好中球と好酸球が増加します。多くは血小板の増加もともないます。
確定診断のためには骨髄内の細胞の状態や芽球割合を分析し、白血病細胞に特徴的なフィラデルフィア染色体があるかどうかを調べる必要があります。
また、増加している好中球は、顕微鏡で観察したときには一見正常に見えますが、好中球アルカリフォスファターゼ(NAP)活性という数値が明らかに低下し、正常白血球とは異なることがわかります。
この判別が、他の白血球増多症との重要な鑑別点となります。
慢性骨髄性白血病の原因
この病気の直接的な原因は、『フィラデルフィア染色体(Ph:Philadelphia chromosome)』という遺伝子異常によるものです。
しかしながら、なぜ突然染色体の一部が入れ替わって遺伝子異常が形成されるのかはわかっていません。
この染色体異常は生まれ持ったものではなく後天的なもので、それに関わる要因は不明のままです。
フィラデルフィア染色体とは、
フィラデルフィア染色体は、染色体のうちで9番染色体と22番染色体の一部がそれぞれ切断し、入れ替わってしまった結果生じたものです。
この染色体では、本来離れているはずのABL遺伝子とBCR遺伝子が隣り合わせになり(BCR-ABL融合遺伝子)、細胞への情報伝達が通常とは違う働きになってしまいます。
BCR-ABL融合遺伝子上では、細胞の増殖に関わるチロシンキナーゼという酵素が常時働き、本来自然に老いて死んでいくはずの細胞が不死化し、無限に増殖を続ける状態になります。
慢性骨髄性白血病の治療で使用されるイマチニブ(商品名:グリベック)などの薬は、チロシンキナーゼの働きを抑え、白血病細胞が増殖し続けられないようにする仕組みです。
イマチニブなどはチロシンキナーゼ阻害薬と呼ばれ、フィラデルフィア染色体陽性の白血病に対しては、高い有効性が認められています。
『フィラデルフィア染色体』の名前は、1960年代にアメリカ・ペンシルベニア州フィラデルフィアの研究者によって発見されたことから命名されました。
慢性骨髄性白血病の検査
病気を正しく診断し、病状を正確に知るために、初診時や治療開始前には多くの検査が行われます。
治療開始後も、治療効果や副作用を確かめるために定期的な検査を行います。
主な検査は血液検査、骨髄検査、画像検査などです。
慢性骨髄性白血病ではとくに、遺伝子検査が欠かせません。
血液検査
①血球検査
血液検査では、血液中の赤血球・白血球・血小板の数を調べ、白血球の目視による分画検査も行います。
慢性骨髄性白血病は白血球細胞の分化と増殖に異常がおこるため、とくに白血球の中の好中球の成熟状態を調べます。
慢性骨髄性白血病では、骨髄球系の細胞が、未熟な段階 (芽球)から成熟した段階までまんべんなく増加することが特徴です。
なかでも好塩基球が増加します。
この状態が確認されたときは慢性骨髄性白血病を疑い、さらに詳しい検査へ進みます。
②生化学検査
血液検査の一般生化学検査では、ビタミンB12が高値を示すことが特徴です。
治療開始後は、初期に高尿酸血症や電解質の異常、肝機能障害などが起こる可能性があるため、定期的な血液検査を行います。
③分子遺伝学的検査
採取した血液の遺伝子をPCR法という方法で増幅させ、慢性骨髄性白血病に特徴的なBCR-ABL融合遺伝子の量を測定します。
この検査は慢性骨髄性白血病の診断補助や、治療効果の確認などで重要な検査です。
④細胞遺伝学的検査(染色体検査)
BCR-ABL融合遺伝子を検出するために、染色体検査を行います。
診断のためには、FISH法という末梢血を用いて行う染色体検査があります。
骨髄検査
通常は骨髄穿刺で骨髄液を抜き、骨髄内の詳細を調べます。骨髄穿刺は、腸骨(骨盤の後ろの骨)に細い注射針を刺して骨髄液を採取します。
骨髄液が採取できないときは、骨髄生検で骨髄の組織の一部を取り出し検査します。
①骨髄像
取り出した骨髄液や骨髄組織を顕微鏡で確認し、骨髄液中の細胞の比率や密度、分化状態を細かく調べます。
②細胞遺伝学的検査(染色体検査)
慢性骨髄性白血病に特徴的なフィラデルフィア染色体が陽性の細胞の有無・比率を調べるため、G分染法という分析を行います。
G分染法は、骨髄細胞中の染色体異常を検出する方法で、慢性骨髄性白血病の確定診断や、治療効果を確認するために利用します。
この方法では、フィラデルフィア染色体が陽性の細胞の比率だけではなく、他の染色体異常の有無も調べることができます。
画像検査
治療開始前には、より適切な治療法を選択するために全身状態を画像検査で調べます。
胸部X線(レントゲン)検査、心電図、心臓の超音波(エコー検査)などを行います。
また、治療中も副作用の有無を確認するため、定期的に上記検査を行います。
慢性骨髄性白血病の治療
慢性期に中心となる治療は、分子標的薬の内服(飲み薬)です。
多くの場合は外来通院で治療が可能です。
薬を欠かさず処方通りに飲み続けることが非常に大切です。飲み忘れると効果が弱まってしまいます。
治療に使うのは『チロシンキナーゼ阻害薬(TKI)』という分子標的薬で、このCMLに特徴的なフィラデルフィア染色体によるチロシンキナーゼの働きを阻害し、無限に生き続ける白血病細胞を死滅させて増殖を抑えます。
それにより白血球・血小板・赤血球の状態を正常に戻し、全身の状態の回復と維持をしながら病期の進行を防ぎます。
移行期・急性転化期に進行すると、慢性期の治療法では十分な効果が得られないため、分子標的薬を増量したり変更します。
抗がん剤治療とTKIの併用、造血幹細胞移植が検討されます。
慢性骨髄性白血病では完全な治癒は困難ですが、薬で病気をコントロールしながら長期安定した状態で生活していくことが可能になってきています。
慢性期の治療
いくつかのチロシンキナーゼ阻害薬の中から薬剤を選択し、基本的には毎日服用を続けます。
この薬は飲み忘れがあると効果が不十分になるため、薬が決まって服用を開始した後は、処方通りに欠かさず服用を続けることがとても大切です。
一番歴史の古いイマチニブ(商品名:グリベック)は、長期間服用したときの効果や安全性に関するデータが十分にある薬ですが、新しい薬に比べると効果が不十分です。
ニロチニブ(商品名:タシグナ)やダサチニブ(商品名:スプリセル)は、イマチニブより新しい薬で、イマチニブに比べて白血病細胞の量を減らすスピードが速いとされています。
さらに新しいTKIとしては、ボスチニブ(商品名:ボシュリフ)やポナチニブ(商品名:アイクルシグ)という薬もあります。
承認されて間もない薬としては、アシミニブ塩酸塩(商品名:セムブリックス)があり、ABLミリストイルポケットを特異的に標的とするSTAMP阻害薬です。
これらの薬剤は、どれが一番優れているというわけではなく、それぞれに飲み方や副作用などの特徴が異なります。
患者さん個々の全身状態や生活様式や希望に合わせ、一番合う薬剤を選択していきます。
服用を開始以降は定期的に検査をして副作用や治療効果を確認しますが、効果が十分ではない場合や、副作用などで服用継続が難しい場合には、薬の変更を検討します。
移行期の治療
治療開始の時点ですでに移行期の場合
- 第二世代のTKIであるダサチニブやニロチニブ、ボスチニブの服用による治療
など、慢性期で使用することのあるイマチニブよりも強力な薬を選択します。
これらで早期に高い治療効果が得られたときは、そのまま継続して慎重な経過観察を行います。
慢性期の治療中に移行期へ進行した場合
- それまでに使用していないTKIへ変更
- 同種造血幹細胞移植ができる年齢では、TKIの効果をみながら実施を検討
急性転化期の治療
- TKI単独もしくは、TKIと抗がん剤の併用治療
- 同種造血幹細胞移植を検討
急性転化期の化学療法では、急性リンパ性白血病の治療と同じ薬剤を使用することが多いですが、治療の効果があっても一時的なものと考えられるため、年齢や全身状態に問題がなく条件がそろえば、造血幹細胞移植を検討します。
移植ができないケースでは、効果的なTKI治療を継続します。
チロシンキナーゼ阻害薬とは?
特定の因子だけをターゲットにした分子標的薬には様々な種類がありますが、慢性骨髄性白血病では、『チロシンキナーゼ阻害薬』の登場で飛躍的に治療効果が良くなりました。
BCR-ABLチロシンキナーゼは、慢性骨髄性白血病に特徴的なフィラデルフィア染色体によって生成されたチロシンキナーゼ活性が常時働くタンパク質です。
この作用によって白血病細胞が不死化し、無限に増殖するようになってしまうと考えられています。また、細胞のさらなる異常にも関わるとされています。
チロシンキナーゼ阻害薬は、チロシンキナーゼの作用を抑えることができ、白血病細胞が死滅するように働いて白血病細胞を減らしていきます。
他の抗がん剤と比較してピンポイントで働くので副作用が少なく、長期で飲み続けていくことが可能です。
最初に開発されたイマチニブが登場したのは2001年のことで、それ以降もニロチニブやダサチニブ、ボスチニブ、ポナチニブなどが順次承認されてきています。
現在も開発は続いており、薬の反応性が悪い難治性のタイプに対しては、遺伝子変異を調べて効果が期待できるTKIに切り替えることがあります。
さらにはTKI無効例には、新しい作用機序のSTAMP阻害作用のあるセムブリックスが登場しました。
現在のところ、薬の服用は生涯にわたって継続する治療になります。
しかし、この先、非常に高いレベルでの安定が維持できる患者さんに対しては、治療を中止できる可能性があり、臨床試験が行われています。
慢性骨髄性白血病の専門治療のご紹介
血液内科は専門性が非常に高く、治療が行えるクリニックは非常に限られています。
このため大きな病院に患者さんが集まっており、平日に通院し長時間待っての診察となっているのが現状です。
当院では周辺の大学病院や総合病院の血液内科専門医と協力し、専門的な治療と社会生活を両立できることをコンセプトに立ち上げました。
上野院だけでなく、神奈川の武蔵小杉院・元住吉院にて、血液内科専門医による外来を行っております。
- 大学病院:日本医科大学・順天堂大学・東京大学・慈恵会医科大学・昭和医科大学
- 総合病院:永寿総合病院・三井記念病院・NTT東日本関東病院・関東労災病院
お近くで慢性骨髄性白血病でお悩みの方は、どうぞご相談ください。
また当法人への通院が困難な方につきましては、イシュランをご参照ください。
こちらでは、科学的根拠にもとづいた骨髄増殖性腫瘍(MPN)治療を行っている全国の病院や医師をご紹介しています。
【お読みいただいた方へ】
医療法人社団こころみは、東京・神奈川でクリニックを運営しています。
「家族や友達を紹介できる医療」を大切にし、社会課題の解決を意識した事業展開をしています。
上野御徒町こころみクリニックでは、血液患者さんの治療と社会生活の両立を目指し、大学病院と夜間連携診療を行っています。
医療職はもちろんのこと、法人運営スタッフ(総合職)も随時募集しています。
取材や記事転載のご依頼は、最下部にあります問い合わせフォームよりお願いします。
![画像名の[sample]の部分に記事の名前を入れます](https://ueno-okachimachi-cocoromi-cl.jp/wp-content/uploads/2023/01/378123a85308949b14579f3b1dd9a9c4.png)
監修医師紹介
山口 博樹
日本医科大学血液内科 大学院教授/上野御徒町こころみクリニック顧問
日本内科学会/日本血液学会(評議員)/日本造血・免疫細胞療法学会(評議員)
総合内科専門医/総合内科指導医/日本内科学会認定内科医/血液専門医/血液指導医/がん治療認定医/日本造血・免疫細胞療法学会認定医/骨髄移植推進財団ドナー調整医師
![画像名の[sample]の部分に記事の名前を入れます](https://ueno-okachimachi-cocoromi-cl.jp/wp-content/uploads/2025/03/dr_watanabe_s.png)
執筆医師紹介
渡邊 直紀
順天堂大学医学部内科学血液学講座 准教授
日本内科学会/日本血液学会
日本内科学会認定内科医・指導医/日本血液学会認定血液専門医・指導医/日本がん治療認定医機構 がん治療認定医/ICLSインストラクター/日本内科学会総合内科専門医/JMECCインストラクター
カテゴリー:こころみ医学 投稿日:2022年8月26日
関連記事
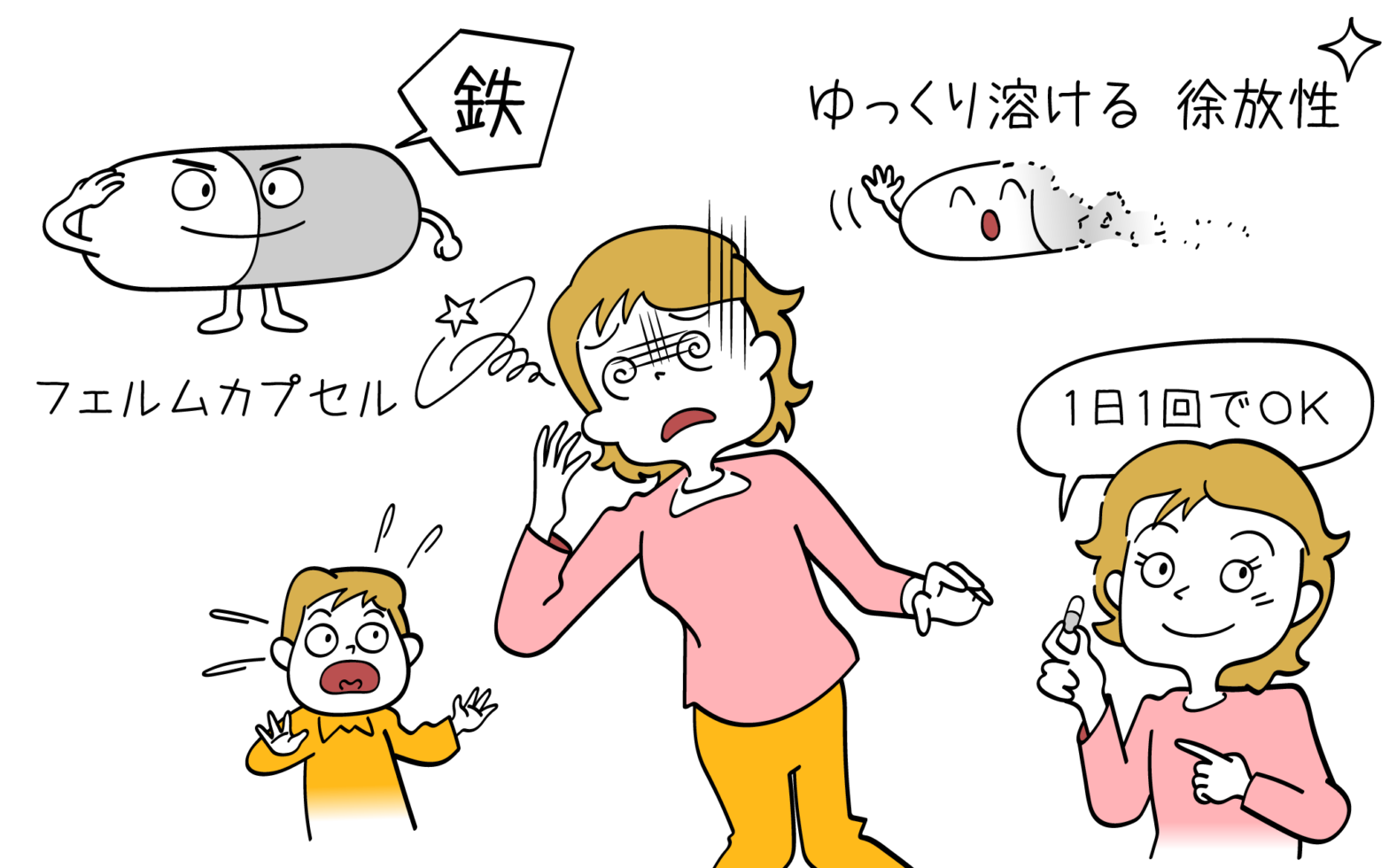
【販売中止】フェルムカプセル(一般名:フマル酸第一鉄カプセル)の効果と副作用
フェルムカプセル(一般名:フマル酸第一鉄カプセル)は、鉄欠乏性貧血に処方されるカプセル剤です。 徐放性の薬剤であり、1日の内服回数を少なくすることで服用の負担を軽減できます。 今回は、フェルムカプセルの効果や副作用につい… 続きを読む 【販売中止】フェルムカプセル(一般名:フマル酸第一鉄カプセル)の効果と副作用
投稿日:
人気記事

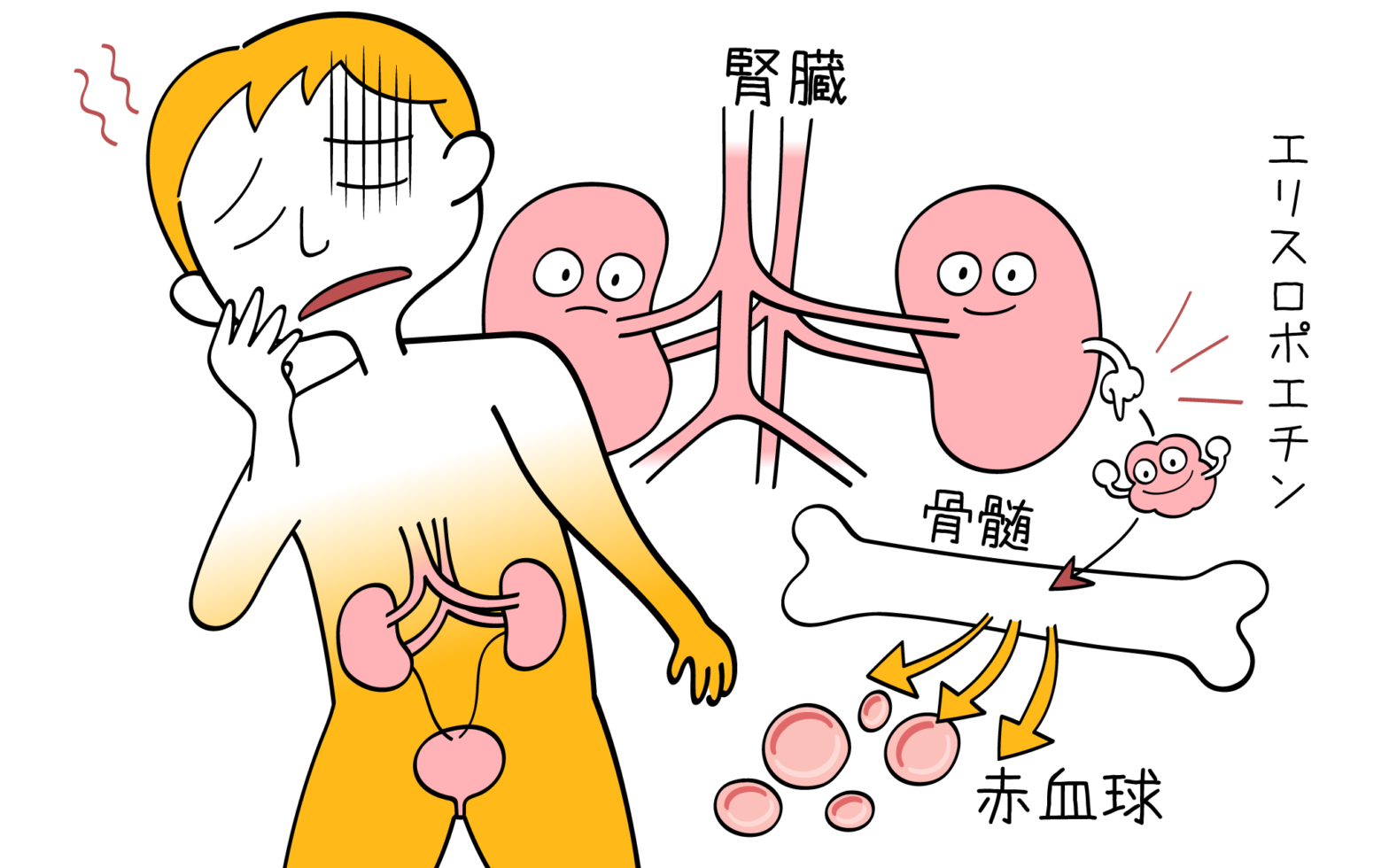
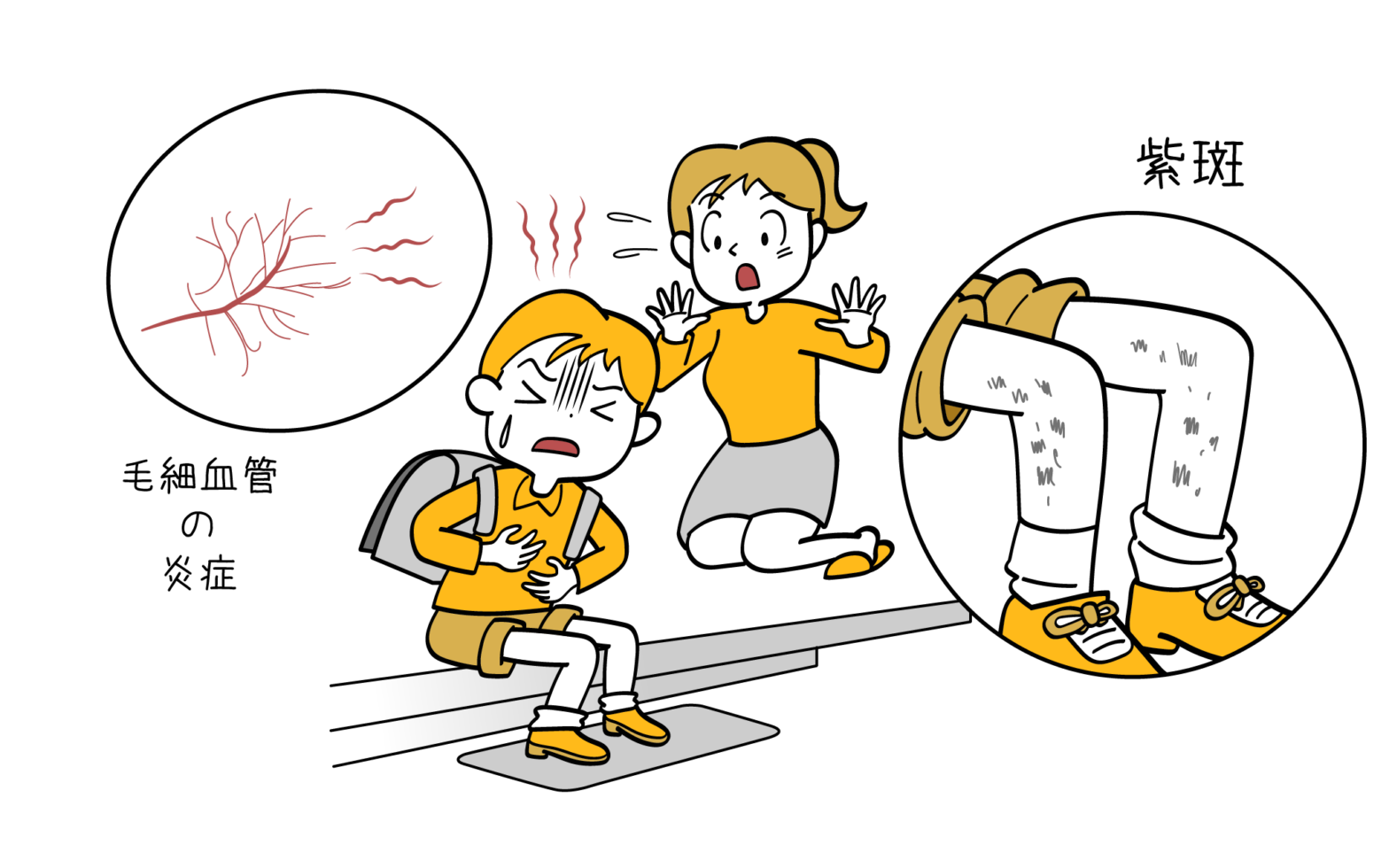
紫斑病の症状・診断・治療
紫斑病とは? 紫斑病とは、止血に重要な働きをしている血小板が減少してしまうことなどで、血が止まりにくくなっているときに起こります。 その原因は様々で、血小板の機能に異常がある場合、凝固因子といわれる止血に必要なタンパクが… 続きを読む 紫斑病の症状・診断・治療
投稿日: