骨髄異形成症候群の症状と予後
MDSは、減少する細胞とその減少の程度によって現れる症状が異なります。
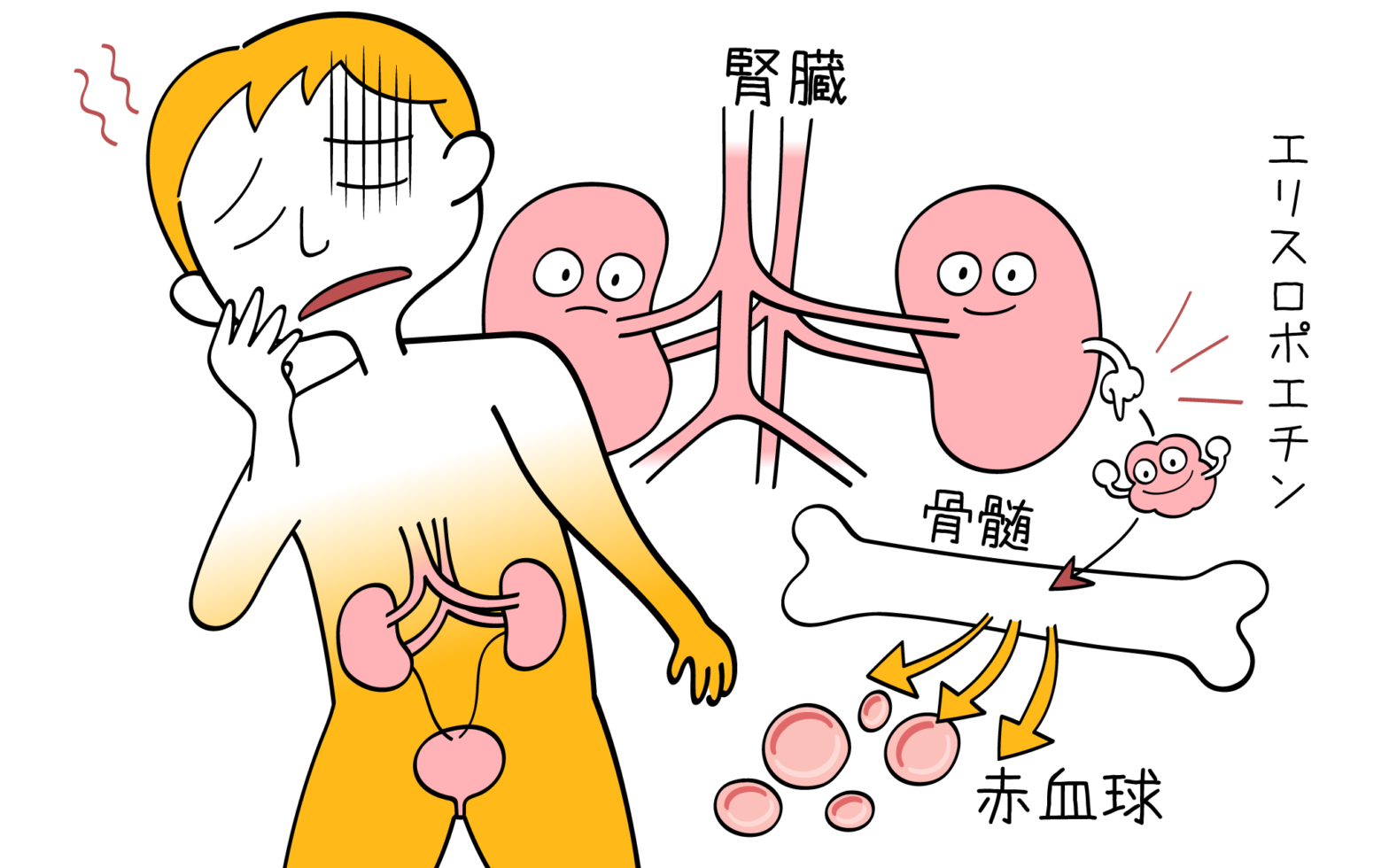
- 赤血球減少:貧血、易疲労感、めまい、動悸、息切れなど
- 白血球減少:易感染状態、発熱など
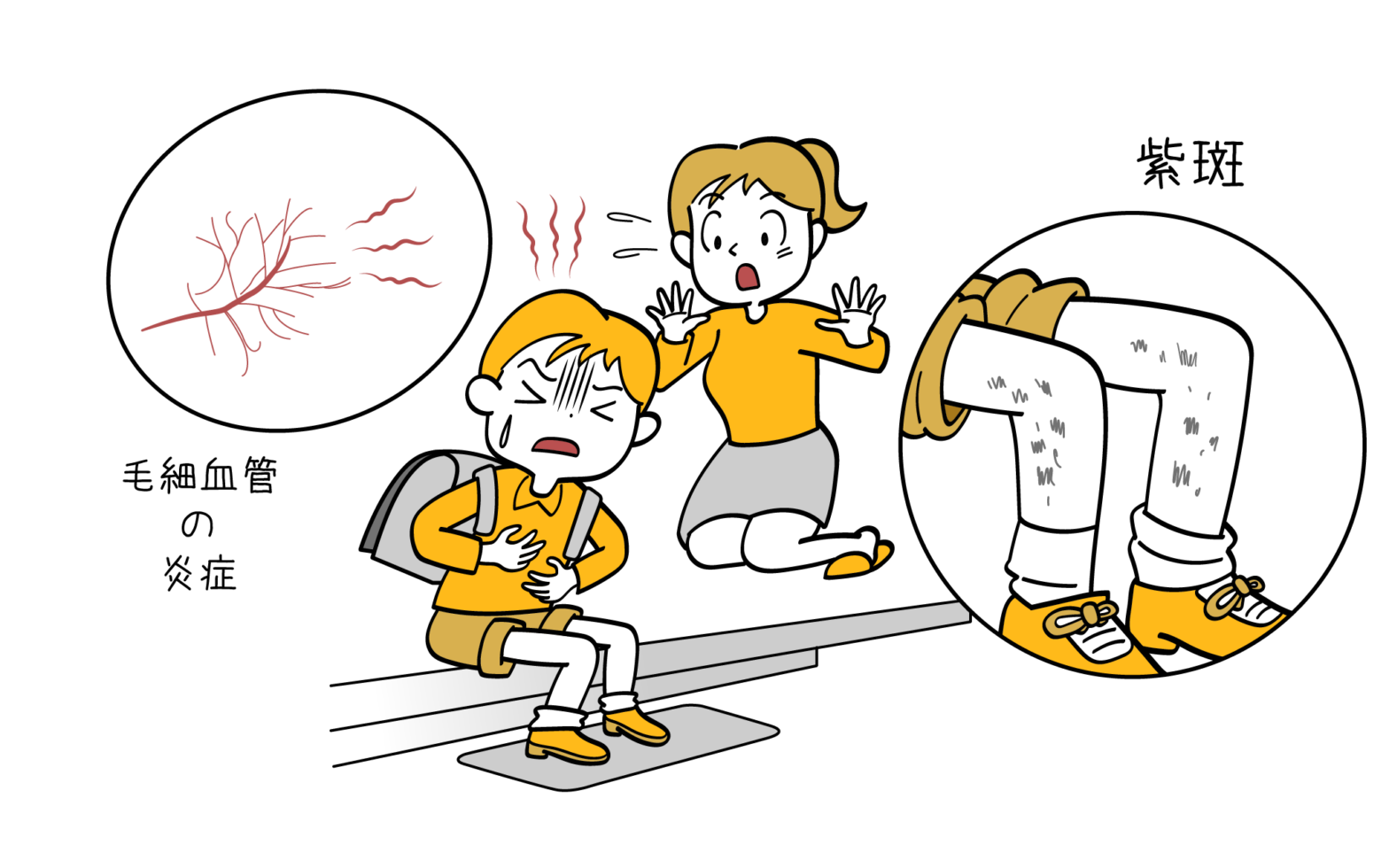
- 血小板減少:出血傾向、皮膚の点状出血、鼻出血など
一般的な固形癌の様に急激に症状が進行するものではなく、ゆっくり進行するため病気が発症しても症状が現れることなく無症状で経過する場合もあります。
骨髄異形成症候群を疑うきっかけになるのは、鉄欠乏以外が原因の高齢者貧血で、それ以外の血球減少も認められるときになります。
骨髄異形成症候群の予後とは?
MDSは末梢血や骨髄の所見を基に、高リスクと低リスクに分類されます。
無効造血の側面が強い場合は低リスク群とされることが多く、予後は比較的良好です。
白血病化の側面が強い場合は高リスク群とされ、予後不良とされています。
MDSの約1/3は急性骨髄性白血病に移行し、移植が不適応となった高リスク群の予後は半年~1年程度です。
骨髄異形成症候群のリスク分類
治療方針は、分類されたリスクに応じて決められます。
リスクの分類はIPSSという分類表を用いて行います。
改訂IPSSでは、遺伝子異常に基づく分類がありますが、イメージがつきにくいのでIPSSをご紹介します。

染色体異常と骨髄芽球割合、血球減少の項目の点数を足して合計点数を出すます。点数からリスクがわかります。

骨髄異形成症候群の治療法
おもに3つの治療法があります。
それぞれ、ご説明していきます。
支持療法
根本的な治療ではなく、出現している症状に対して対症的に行う治療法のことです。
- 赤血球輸血:進行した貧血を改善する
- エリスロポエチン製剤:赤血球を増やす
- 鉄キレート療法:赤血球輸血によって体内で増えた鉄を除去する
- 血小板輸血:出血傾向を改善する
- G-CSF製剤:白血球を増やす
- 抗菌薬:感染の予防目的と治療
化学療法
抗がん剤を用いて腫瘍細胞の増殖を抑制、または死滅させる治療法のことです。
正常な細胞も攻撃することになるので、副作用を伴います。
- 骨髄抑制(血液細胞の減少)
- 悪心嘔吐
- 食欲不振
- 口内炎
- 下痢
- 脱毛
- 倦怠感
造血幹細胞移植
自分が持っている造血幹細胞とドナーの造血幹細胞を総入れ替えする治療法です。
入れ替わった新たな造血幹細胞によって、造血機能の正常化を図ります。
MDSに根治治療はなく、造血幹細胞移植が治癒を期待できる唯一の治療法です。
しかし、造血幹細胞移植は体への負担がかなり大きく、高齢者では適応にならないことも多くあります。
低リスク群の治療方針
無症状、または症状があっても軽い場合は、経過を見ながら必要に応じて支持療法を行います。
症状が目立つ場合や、遺伝子異常があって治療効果が期待できる場合などは、総合的に見て高リスクの治療法も考慮していきます。
高リスク群の治療方針
白血病に進行(転化)してしまう可能性も高いため、積極的に治療を行っていきます。
移植が実施不可能な場合
抗がん剤のアザシチジン(商品名:ビダーザ)が第一選択薬となります。
効果が現れるまでには約半年程度かかりますが、効果がある間は投与を継続します。
通常の抗がん剤に比べ副作用が少ない特徴があります。
アザシチジンの効果がない、または投与できない場合には、全身状態や年齢などを考慮しながら白血病治療に用いる抗がん剤も検討されます。
染色体所見で5番染色体長腕部欠損が判明している場合は、レナリドミド(商品名:レブラミド)という抗がん剤を用いた治療についても考慮されます。
移植が実施可能な場合
年齢やHLA合致ドナーの存在、合併症の有無などを考慮し、可能であれば速やかに造血幹細胞移植を行います。
造血幹細胞移植の流れは、
前処置
移植前に多量の化学療法や全身放射線照射などを行い、腫瘍細胞やわずかに残っている正常な血液細胞(主に免疫担当細胞)の根絶を図ります。
この前処置を行うことが、移植後の拒絶反応や疾患の再発を防ぐことにつながります。
移植
②移植
ドナーから提供された新たな造血幹細胞を注入します。
移植後の管理
③移植後の管理
移植後はドナーの細胞が患者(宿主)の細胞を攻撃するGVHDや感染症など、様々な合併症が起こるため管理が重要となります。





![画像名の[sample]の部分に記事の名前を入れます](https://ueno-okachimachi-cocoromi-cl.jp/wp-content/uploads/2023/01/378123a85308949b14579f3b1dd9a9c4.png)
![画像名の[sample]の部分に記事の名前を入れます](https://ueno-okachimachi-cocoromi-cl.jp/wp-content/uploads/2025/03/dr_watanabe_s.png)